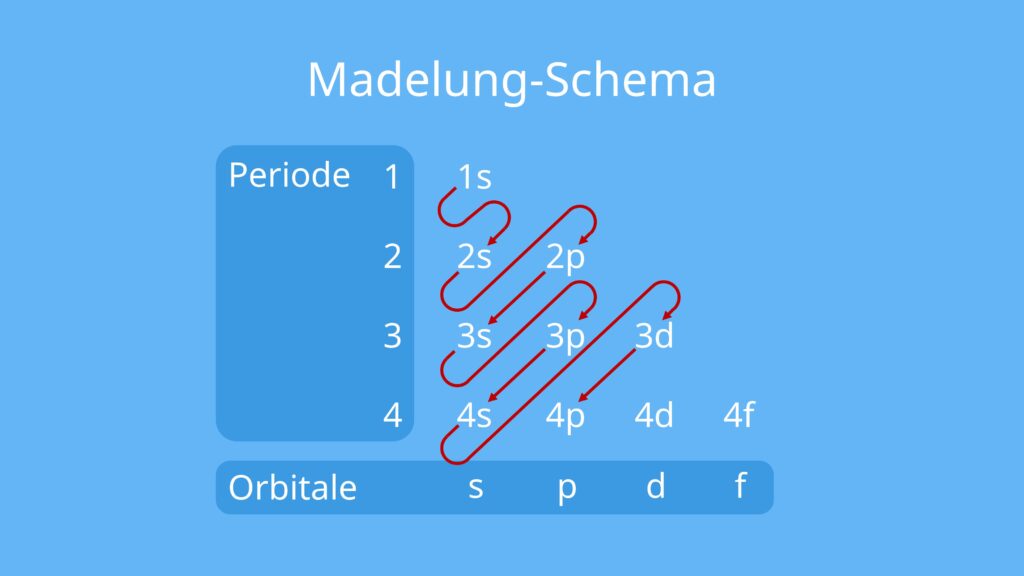
Antwort Warum kommt 4s vor 3d? Weitere Antworten – In welcher Reihenfolge werden Orbitale aufgefüllt
Von dieser Reihenfolge gibt es mehrere Ausnahmen, unter anderen: Bei Lanthan besetzt zuerst ein Elektron ein Orbital der 5d-Unterschale bevor 4f aufgefüllt wird, bei Actinium besetzt entsprechend ein Elektron 6d bevor 5f aufgefüllt wird. Die Elektronen besetzen zuerst leere Orbitale innerhalb einer Unterschale.Orbitale beschreiben den wahrscheinlichen Aufenthaltsort der einzelnen Elektronen und ermöglichen so die Vorstellung von bestimmten räumlichen Anordnungen, vor allem, wenn die Atome chemische Bindungen eingehen. Ein Atom wird in Atomkern und Atomhülle gegliedert.Deshalb spricht man vom 1s-Orbital und schreibt 1s2. 2 Elektronen sind dem s-Orbital mit der Hauptquantenzahl 2 (= L-Schale) zugeordnet, die man mit 2s2 beschreibt, und es befindet sich jeweils ein Elektron auf dem px- und py-Orbital, ebenfalls mit der Hauptquantenzahl 2 (= L-Schale).

Welche Werte können die 4 Quantenzahlen prinzipiell annehmen die man zur Beschreibung des Zustands eines Elektrons benötigt : Die Elektronenkonfiguration basiert auf den Theorien von Elektronenschalen und Orbitalen. Die Energieniveaus der Orbitale geben die Reihenfolge an, in der sie besetzt werden. Mithilfe der vier Quantenzahlen n, m, l und s lassen sich die Elektronen genau beschreiben.
Warum wird das 4s Orbital vor dem 3d Orbital besetzt
Die 4s-Orbitale werden also vor den 3d-Orbitalen besetzt, weil sie energetisch tiefer liegen.
Wie funktioniert das Orbitalmodell : Im Orbitalmodell sind anders als im Schalenmodell die Elektronen eines Atoms auf mehrere Orbitale verteilt. Die Elektronen bewegen sich nicht wie im Schalenmodell in Kreisen um den Atomkern, sondern ungerichtet in den Orbitalen. Das einfachste Orbital hat die Form einer Kugel.
In der 3. Schale (M-Schale) sind maximal 18 Elektronen untergebracht (3s, 3p und 3d) In der 4. Schale (N-Schale) sind maximal 32 Elektronen untergebracht (4s, 4p, 4d und 4f)
Das Orbitalmodell ist ein Atommodell, welches versucht, das Atom in seiner Einheit und seinen Bestandteilen (Protonen, Neutronen, Elektronen) näher zu beschreiben, um so wiederum chemische Vorgänge besser erläutern zu können.
Wie werden die Schalen aufgefüllt
Besetzungsregel. Prinzipiell werden die Schalen von innen nach außen aufgefüllt. Das bedeutet, dass erst eine weiter außen liegende Schale mit Elektronen besetzt wird, wenn die innere Schale vollständig befüllt ist. Die Schalen werden dabei von innen nach außen mit der Buchstabenfolge K, L, M, N, O, P, Q beschriftet.Die vier Quantenzahlen beschreiben Elektronenzustände verschiedener Energie und Geometrie. Mit den vier Quantenzahlen lässt sich der Zustand eines Elektrons in Bezug auf den Atomkern eindeutig formulieren.Inhaltsverzeichnis
- 3.1 Hauptquantenzahl.
- 3.2 Nebenquantenzahl.
- 3.3 Magnetische Quantenzahl des Bahndrehimpulses.
- 3.4 Spinquantenzahl.
Im Orbitalmodell ist der Zustand eines Elektrons in einem Atom vollständig durch diese vier Quantenzahlen definiert. Sie sind ein integraler Bestandteil des Pauli-Exklusionssatzes, der besagt, dass kein Elektron innerhalb eines Atoms die gleiche vier Quantenzahlen haben kann.
Wie entstand das Orbitalmodell : Im Jahr 1924 stellte der französische Physiker Louis de Broglie [B1] die Hypothese auf, ein Elektron sei nicht nur als kleines Teilchen zu betrachten, sondern es besitze auch die Eigen- schaften einer Welle. Dies war eine wichtige Grundlage für die Entwicklung des Orbital- modells.
Warum braucht man das Orbitalmodell : Das Orbitalmodell ist ein Atommodell, welches versucht, das Atom in seiner Einheit und seinen Bestandteilen (Protonen, Neutronen, Elektronen) näher zu beschreiben, um so wiederum chemische Vorgänge besser erläutern zu können.
Wie ist das Orbitalmodell entstanden
Im Jahr 1924 stellte der französische Physiker Louis de Broglie [B1] die Hypothese auf, ein Elektron sei nicht nur als kleines Teilchen zu betrachten, sondern es besitze auch die Eigen- schaften einer Welle. Dies war eine wichtige Grundlage für die Entwicklung des Orbital- modells.
In der 4. Schale (N-Schale) sind maximal 32 Elektronen untergebracht (4s, 4p, 4d und 4f)Die vierte Quantenzahl s bezieht sich auf den Spin des Elektrons in einer Wolke. s kann den Wert -1/2 und +1/2 annehmen.
Sind Quanten Energie : Quanten [von *quant- ], Bezeichnung für die kleinsten Energiebeträge (Energiequanten; Energie), die bei mikrophysikalischen Vorgängen als Ganzes, z.B. von Atomen, aufgenommen oder abgegeben werden. Die Quanten sind als Teilchen zu betrachten, die den Feldern, z.B. elektromagnetisches Feld, zuzuordnen sind.